Защита металла от коррозии
Коррозии подвергается почти 1/3 вводимого в эксплуатацию металла. Часть его переплавляется и снова возвращается в промышленность. Но, всё-таки, 10% от общей массы - теряется безвозвратно. Разрушение отдельных металлических деталей из металла может привлечь за собой разрушение целых машин и механизмов, создавая аварийные ситуации. В связи с чем, создавая металлические предметы, устройства, механизмы, большое внимание следует уделять защите металла от коррозии. Радикальным методом защиты от коррозии является поиск коррозионно-стойких материалов для агрессивной среды. Полностью заменить металлы на неметаллические предметы - невозможно.
Защита металла от коррозии позволяет своевременно и надёжно изолировать металл от агрессивной среды.
Способы защиты металла от коррозии
Одним из способов защиты металл от коррозии является создание на его поверхности защитной плёнки - покрытия. Пути создания защитных плёнок различны. Например, корродирующий металл покрывают слоем другого металла, который не разрушается при тех же условиях. В качестве покрытий используются неметаллические покрытия, органические материалы - плёнки высокополимерных веществ, лаки, олифа, а также композиции из высокополимерных и неорганических красящих веществ.Особое значение имеют плёнки из оксидов металлов, получаемые при действии кислорода или подходящих окислителей (азотная кислота HNO3, дихромат калия K2Cr2O7 и др.) на поверхность металлов. Часто такие оксидные плёнки образуются на поверхности металлов даже просто при соприкосновении с воздухом, что делает химически-активные металлы (алюминий, цинк) коррозионностойкими. Подобную роль играют защитные нитридные покрытия, образующиеся при действии азота или аммиака на поверхность некоторых металлов. Искусственное оксидирование, азотирование, фосфатирование - хорошая защита металлов от коррозии
Другим способом защиты металла от коррозии является электрохимическая защита от коррозии.Электрохимическая защита от коррозии
Этот способ защиты металла от коррозии заключается в изменении потенциала защищаемого металла и не связана с его изоляцией от коррозионной среды (то есть, в этом случаем изделие модет находится в агрессивной среде). К данному способу защиты относится катодная защита от коррозии. Её называют также анодная защита.
Катодная защита от коррозии
Катодная защита от коррозии заключается в том, что защищаемая конструкция "А", находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженный электрод) источника электричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
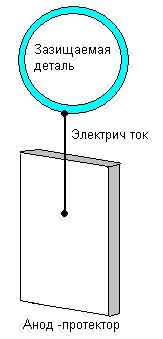
Протекторная защита отличается от катодной защиты от коррозии тем, что для её осуществления
используется специальный анод - протектор, в качестве которого применяют металл более
активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой
конструкцией проводником электрического тока. В процессе коррозии протектор служит анодом
(положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу
охраняемую конструкцию.
Рассмотрим коррозионный процесс повреждения металлических защитных покрытий.
1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений).
2. Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк.
Из этих случаев можно сделать Важный вывод, что белее надёжное защитное покрытие то, что из металла более активного, чем защищаемый металл.
Еще одним способом защиты металла от коррозии является использование ингибиторов коррозииИнгибиторы коррозии
Ингибиторы - вещества, замедляющие процесс химической реакции (процесса коррозии). Для защиты металла от коррозии или замедления процесса корродирования в агрессивную среду добавляют вещества (чаще всего органические) - ингибиторами коррозии. Таким способом защиты успешно пользуются, когда надо защитить металл от его разъедания, например, кислотой. Ингибиторы коррозии широко применяются при очистке паровых котлов от накипи, для снятия окалины с отработанных деталей, а также при хранении и перевозке соляной кислоты в стальной таре.
В качестве органических ингибиторов коррозии применяют тиомочевину (химическое название - сульфид-диамид углерода C(NH2)2S ), диэтиламин, уротропин (CH2)6N4) и другие производные аминов.
В качестве неорганическихингибиторов коррозии применяют силикаты (соединения металла с кремнием Si), нитриты (соединения с азотом N), дихроматы щелочных металлов и т.д. Иногда путём удаления из воды кислорода можно добиться также снижение коррозионных свойств воды. А делают это путём фильтрования воды через слой железной стружки!
Чистка стальных предметов
Устранить ржавчину механическим способом практически невозможно. Поэтому часто применяют растворы, содержащие сильнодействующие химические реактивы - кислоты, основания и т.д. Вместе с устранением ржавчины достигается эффект предохранения поверхности от внешних воздействий. Несильно загрязнённые и поржавевшие предметы на несколько часов замачивают в бензине, а затем грязь и ржавчину удаляют салфеткой, смоченной бензином или металлической щёткой при глубокой ржавчине. Стальные предметы хорошо чистятся пастой, состав которой следующий: машинное масло - 650 г, парафин - 150 г, очень мелкая пемза - 200 г или тяжёлый бензин - 270 г, абразивный порошок - 450 г, алюминиевый порошок - 40 г.
Чистка цветных металлов
В фарфоровом сосуде растапливают 100 г парафина, 200 г олеина, 200 г овечьего жира. В полученную смесь добавляют 500 г порошка мела и размешивают до полной гомогенизации.
Чистка серебра
В фарфоровой или эмалированной сосуде в 100 мл тёплой воды последовательно растворяют 300 г белого мыла, 150 г щавелевой кислоты, 150 г карбамида кальция.
 Перейти на английский
Перейти на английский