
Сложные вещества
Сложные вещества - это химические вещества, образованные соединением нескольких простых веществ. В хозяйстве в большей степени мы пользуемся сложными веществами и в гораздо меньшей степени - простыми веществами.
К используемым нами сложным веществам относятся соли (c химической точки зрения), оксиды, основания или щелочи, кислоты, а также многие органические соединения, например спирты, парафины, альдегиды и т.д.
Вода
| Ваш вес | Дневная норма воды |
| 18 кг | 0,5 л |
| 27 кг | 0,75 л |
| 36 кг | 1,0 л |
| 45 кг | 1,25 л |
| 54 кг | 1,5 л |
| 63 кг | 1,75 л |
| 72 кг | 2,0 л |
| 81 кг | 2,25 л |
| 90 кг | 2,5 л |
| 99 кг | 2,75 л |
| 108 кг | 3,0 л |
| 117 кг | 3,25 л |
| 126 кг | 3,5 л |
| 135 кг | 3,75 л |
| 144 кг | 4,0 л |
Вода - сильный растворитель. Как вы думаете, при какой температуре вода больше весит?
Наибольшая плотность воды зафиксирована при температуре 4°С, выше и ниже этой температуры плотность постепенно уменьшается. Соответственно, и весит вода больше всего при 4°С.
Дистиллированная вода по вкусу отличается от водопроводной. Это объясняется тем, что в обычной воде растворены десятки различных солей ,- это соли кальция (присутствие данных солей затрудняет образование мыльного раствора при стирке), магния (обычно придаёт горечь воде), а также соли железа, щелочных металлов и много других веществ.
Вода, обогащенная ионами металлов, полезна для организма (но не из-под крана!). Например, калий и магний - для работы сердечных мышц, кальций и железо – для свёртывания крови, натрий - для образования минеральных солей, имеющих щелочную реакцию и способных расщеплять органические вещества.
Всем известно, что организм человека состоит на 81% из воды и, конечно же, постоянно нуждается в её пополнении. Поэтому сужествует норма приёма воды организмом человека в зависимости от веса человека:
Жёсткость воды
Жёсткость воды - определяется наличием в воде катионов кальция (Ca) и магния (Mg). Чем выше содержание этих катионов, тем больше жёсткость воды. Существует временная жёсткость воды и постоянная жёсткость воды. Временная жёсткость устраняется при кипячении. Соли, растворённые в воде (гидрокарбонаты кальция и магния Ca(HCO3)2, Mg(HCO3)2) легко распадаются при нагревании,образуя воду и углекислый газ:
Ca(HCO3)2→ CaCO3+H2O+CO2
Mg(HCO3)2→ MgCO3+H2O+CO2
Постоянная жёсткость воды кипячением удалить невозможно. Такая вода содержит соли - сульфаты, хлориды, нитраты кальция, магния. Но всё-таки можно избавиться и от постоянной жёсткости воды: используем известковое молоко (гашеная известь - Ca(OH)2) или соду.
Одним из наиболее эффективных средств устранения постоянной жёсткости воды является использование ортофосфата натрия (Na3PO4). При взаимодействии его с водой соли, придающие воде жёсткость, выпадают в осадок:
Ca(HCO3)2 +2Na3PO4→ Ca3(PO4)2 (осадок)+ 6NaHCO3
3MgSO4+2Na3PO4→ Mg3(PO4)2 (осадок) + 3Na2SO4
При кипячении жёсткой воды на стенках посуды образуется накипь - соли кальция и магния. Они плохо проводят тепло. Если накипи образовалось много, то стенки посуды могут перегреться.
При стирке в жёсткой воде мыла расходуется значительно больше. Это связано с образованием нерастворимых в воде сложных веществ - стеаратов кальция и магния (Ca(C17H35C00)2 и Mg(C17H35COO)2)
В жёсткой воде и овощи варятся дольше, так как углеводы, содержащиеся в овощах, образуют с солями кальция и магния нерастворимые сложные вещества.
Вода и Лёд. Почему вода тяжелее льда?!
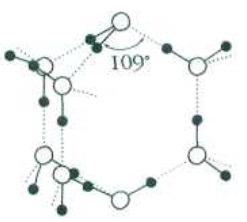
Фрагменты (Н2О)8 сохраняются и в жидкой воде. Внутрь таких агрегатов попадает часть молекул Н2О, поэтому плотность воды оказывается выше плотности льда (900 кг/м3)
О проточной питьевой воде:
Все знают, что обезвреживание проточной воды производят с помощью хлорки, или точнее раствора,содержащего хлор. Микроорганизмы в такой среде выжить не могут и гибнут. Но при этом ухудшается и качество воды, ведь хлор - очень сильный окислитель, вступает в химическую реакцию с растворёнными в ней примесями и образует хлорорганические соединения, вредные для здоровья. Одни из самых токсичных и вредных веществ - диоксины. Эти вещества - самые настоящие яды! Они поражают органы человека, нарушают их правильное функционирование. Не всегда и фильтры могут справляться с переизбытками растворённого хлора.
Из всей воды, на нашей планете только 1% пригодна для питья. Несмотря на то, что существует большое разнообразие различных очистительных фильтров, даже самый лучший фильтр (содержащие слои ионообменной среды, активированного угля) не способен устранить все токсичные вещества из воды. получить чистую воду можно регулярной заменой фильтра (картриджа), при этом надо учитывать, источник, из которого берётся вода и как очищается (например, в особо загрязнённых районах фильтр нужно менять чаще, так как он быстрее портится).
Самую чистую и полезную воду получают из природных источников, которая предварительно обрабатывается, дополнительно очищается и разливается в стеклянные бутылки!
Снежинки
Снег образуется, когда микроскопические капельки воды в облаках притягиваются к частичкам пыли и замерзают. Кристаллики льда, которые при этом появляются, не превышают сначала 0,1мм в диаметре, падают вниз и растут из-за конденсации на них влаги из воздуха. При таком движении образуются шестигранные кристаллические формы. Через структуру молекул воды между вершинами кристалла возможно образование углов размерами лишь 60 и 120 градусов. Основной кристалл воды имеет в горизонтальной плоскости форму правильного шестиугольника. На вершинах этого шестиугольника оседают новые кристаллы, на них – новые и таким образом образуются различные формы звёздочек – снежинки.

При достаточно высокой температуре воздуха кристаллы неоднократно тают и снова кристаллизируются. Это нарушает правильную форму снежинок и образует смешанные разновидности. Кристаллизация всех шести углов снежинок происходит одновременно в практически одинаковых условиях и, поэтому, формы углов снежинок получаются тоже одинаковыми.
С точки зрения кристаллографии наиболее естественной формой снежинок является «шестиугольная» симметрия. При этом в природе широко распрострастранены треугольные снежинки. Причины такого различия до настоящего времени остаются неизвестными.
Для образования треугольной снежинки необходима температура 2 градуса ниже нуля.
Новое исследование проведено американскими физиками по количественным оценкам влияния различных факторов на рост снежинки. Как считают физики, имеется 2 основных фактора: динамика диффузии молекулы воды в воздухе и динамика поведения этих молекул на поверхности кристалла. Им удалось установить, что эти параметры непосредственно определяются потоками воздуха, которые охватывают снежинку. Свои теоретические допущения учёные проверили с помощью специальной «снежной машины» - камеры, с помощью которой можно контролировать рост снежинок. В результате было определено, что треугольные снежинки являются наиболее стойкими, то есть изменение потоков воздуха не приводит к изменению формы снежинки. Именно это, по мнению учёных, объясняет распространение треугольных снежинок.
Совсем недавно учёным из Великобритании удалось получить «пятиугольник» снежинку. Они разместили тонкий слой льдинок на поверхности меди. В этом слое молекулы воды разместились в вершинах пятиугольников.
 Перейти на английский
Перейти на английский