Электролиз - это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз - это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать - рассказано дальше) и, конечно, электролит. Электролит - это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие - в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно - анод. Электрод, заряженный отрицательно - катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину.
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
В домашних условиях, из тех веществ, что имеются практически у каждого, можно без труда получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щёлочь! Но будьте осторожны с хлором - этот газ ядовит!
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у "+" будет выделяться кислород, у "-" водород. Именно такое распределение газов происходит из-за того, что возле анода "+" происходит скопление отрицательных ионов OH-, и восстановление кислорода, а возле катода "-" скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na2CO3), имеющие положительный заряд (Na+) и одновременно происходит восстановление водорода. Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li <K <Rb <Cs <Ba <Ca <Na <Mg <Al <Mn <Cr <Zn <Fe <Cd <Co <Ni <Sn <Pb <H2 <Cu <Ag <Hg <Pt <Au
В следующем опыте по электролизу будем получать чистую медь (Cu).
Для этого нам потребуется раствор медного купороса CuSO4, который содержит растворённую медь. Медь стоит в ряду напряжений металлов после водорода, поэтому она и будет выделятся на электроде. Приготовьте раствор медного купороса, опустите в него электроды и включите источник питания. Как и в предыдущем опыте с раствором кальцинированной соды, на адоде "+" будет восстанавливаться кислород. В то же время катод "-" будет покрываться тёмно-красным слоем меди, которая восстанавливается из раствора до чистого металла.
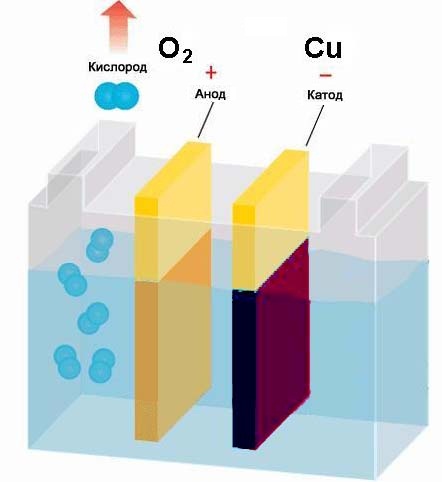
Мы провели 2 опыта по электролизу растворов и можем подвести результат: При пропускании тока через раствор на положительном электроде - аноде - восстанавливаются отрицательно заряженные ионы (в нашем случае - кислород). Отрицательно заряженные ионы ещё называют анионами. На отрицательном электроде - катоде - восстанавливаются положительные ионы (в нашем случае это водород и медь). Положительные ионы называют катионами. Катионами обычно выступают все металлы и водород. Но в некоторых химических соединениях катионами являются газы и неметаллы. Это зависит от степени окисления элемента в химическом соединении.
Проведём ещё один опыт по электролизу. На этот раз мы будем пропускать ток через раствор поваренной соли (NaCl).
Но должен заранее предупредить, этот электролиз нужно проводить в хорошо проветриваемой комнате, так как выделяемый из раствора чистый газ - хлор (Cl2) очень токсичен. Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:

Электролиз раствора поваренной соли. Схема сбора газа
Итак, начнём. Приготовьте раствор поваренной соли (NaCl). К положительному полюсу источника питания подключите инертный электрод (например - графитовый стержень), к отрицательному - подойдёт любой материал, проводящий ток. Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода ("+"). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте "нюхать"его в банке - можно сильно отравится! (Статья о хлоре). На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H2) и восстанавливаться натрий, который будет тут же вступать в реакцию с водой, образуя натриевую щёлочь.
Электролиз расплавов
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ - хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл - натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы. Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
 Перейти на английский
Перейти на английский